一、概 述
電鍍的目的在于使電極表面沉積出致密的、結(jié)合牢固因而能夠?qū)嵱玫腻儗印J聦?shí)上,通過(guò)界面上的化學(xué)和電化學(xué)反應(yīng),均有可能獲得不同類型的放電粒子沉積。由于沉積物具有不同形態(tài)和性質(zhì),其應(yīng)用便有所差異。目前已有幾種不同類型的生產(chǎn)應(yīng)用方案。當(dāng)希望從溶液中提取所需品種的原子時(shí),習(xí)慣稱為電冶煉;若從混有雜質(zhì)原子的材料中要求分離出純粹的物質(zhì)便叫做電解提純或稱作電精煉;如果沉積出的鍍層厚實(shí)而與基材結(jié)合力不強(qiáng),因而能夠分離直接用做制件則稱為電鑄工藝;沉積出的物質(zhì)結(jié)構(gòu)松散而微細(xì)時(shí),目前用來(lái)制作粉末冶金用的粉末等各種粉末材料。至于利用界面上的反應(yīng)來(lái)進(jìn)行氧化、還原、催化、制取氣體、化合物或有機(jī)中間體、促進(jìn)溶解或者清理表面、腐蝕溶解或蝕刻、切削或拋光加工、表面選擇性溶解處理或形成轉(zhuǎn)化膜層等等,均屬于這類界面特性的生產(chǎn)應(yīng)用。
電鍍這種獲取牢固致密而有一定結(jié)構(gòu)的覆蓋層的方法大體上有別于上述種種應(yīng)用。但因?yàn)閼?yīng)用的思路、體系和設(shè)備的近似,雖然形式和結(jié)果不一,往往會(huì)在生產(chǎn)上混雜來(lái)進(jìn)行。這類在界面上通過(guò)粒子電交換而形成的工藝,從原理上均可歸納為電化學(xué)生產(chǎn)。因?yàn)殡婂儽仨毷钩练e的粒子構(gòu)成牢固而致密的覆蓋,所以具有自己的特殊規(guī)律。
電鍍過(guò)程發(fā)生于電極界面,所以要弄清沉積過(guò)程的原理,便要研究離子導(dǎo)體與電子導(dǎo)體相接觸的界面上的基本反應(yīng)和與此相聯(lián)系的各個(gè)不同的反應(yīng)步驟。電子導(dǎo)體與離子導(dǎo)體具有不同的導(dǎo)電機(jī)理,因此在電解過(guò)程中要實(shí)現(xiàn)帶電粒子的放電而跨相轉(zhuǎn)變以沉積成為鍍層,便要經(jīng)歷一系列的轉(zhuǎn)變步驟。首先,將沉積的粒子在界面一邊的介質(zhì)中需要朝向界面輸運(yùn),以便供應(yīng)沉積過(guò)程的需要(傳質(zhì)過(guò)程)。其次才能在界面上反應(yīng),而要完成這樣的反應(yīng)必須先在達(dá)到界面區(qū)域后做一些反應(yīng)前的準(zhǔn)備以便適應(yīng)界面上的交換(表面轉(zhuǎn)化)。然后在電極界面上進(jìn)行電子交換(電化學(xué)步驟)。最終是放電后的粒子在界面另一邊的固相表面形成新相(相生成)。
在生成新相的過(guò)程中,放電的粒子可以聚集成核以形成生長(zhǎng)點(diǎn),也可能直接在表面的活性區(qū)放電。或者粒子先放電并被表面的力場(chǎng)俘獲后仍沿表面運(yùn)動(dòng)(表面擴(kuò)散),以便尋覓基材表面上可能提供的適當(dāng)位置(結(jié)點(diǎn)),或者沿著表面的結(jié)構(gòu)順序外延(外延生長(zhǎng))。在不少情況下,形成的鍍層(新相)與原來(lái)的基材間視情況不同而可能穩(wěn)定也可能并未最后穩(wěn)定。新相的原子還有進(jìn)一步深入基材內(nèi)部(擴(kuò)散或互擴(kuò)),或者發(fā)生某種反應(yīng)(轉(zhuǎn)化),以及可能參與基體材料的相變等等情況發(fā)生。
從工程應(yīng)用來(lái)說(shuō),鍍層至少不能松散或結(jié)合不牢。否則便無(wú)價(jià)值。其次要能具備一定的有用特性和結(jié)構(gòu)以便適應(yīng)所需的用途。實(shí)用的金屬材料都有適當(dāng)?shù)慕Y(jié)構(gòu)。或?yàn)榫B(tài)或?yàn)榉蔷B(tài),結(jié)構(gòu)的影響會(huì)在材料性能上表現(xiàn)出來(lái)。電鍍層的情況也是一樣。
二、鍍液體系
某些單一的金屬鹽,例如硫酸銅、硫酸鋅等,如果配成水溶液而插入電極并通以電流,便能在陰極上沉積出相應(yīng)的金屬沉積層。這類的鍍層一般很難達(dá)到目前人們對(duì)工業(yè)電鍍層性能、質(zhì)量或沉積過(guò)程的工藝性等要求。簡(jiǎn)單的所謂Daniel(丹尼爾)電池,可以說(shuō)是一個(gè)很好的例子。這種早期的原電池,實(shí)現(xiàn)的是無(wú)外電源型的電沉積。由于很難進(jìn)行工藝控制,所以鍍層性能不良而無(wú)法滿足應(yīng)用要求。
因此,近代的電鍍過(guò)程,采用的是一種按要求調(diào)配成的配料體系。一般需要具備下列幾個(gè)方面的功能。
1、金屬供給劑
含有需沉積的金屬離子的可溶性鹽類,用以供給沉積用的金屬。行業(yè)習(xí)慣稱這類金屬鹽為主鹽。但主鹽應(yīng)理解為主要由之提供沉積金屬的鹽,而非在溶液內(nèi)存在的主要的鹽類或主要的存在形式。
2、鍍液改良劑
單一的鹽作為鍍液成分,一般沉積出的鍍層達(dá)不到通常的應(yīng)用要求,如前所述。為了改善沉積出鍍層的性能和質(zhì)量,以及方便實(shí)現(xiàn)工藝過(guò)程的監(jiān)控,一般需要添加一種或多種化合物來(lái)調(diào)整溶液的功能。例如,為了改變放電離子的形態(tài)或調(diào)節(jié)放電的電位,可以加入絡(luò)合劑;為了提高鍍液的電導(dǎo),可以加入導(dǎo)電鹽;為了改善鍍層的結(jié)構(gòu),可以加入有機(jī)添加劑;為了穩(wěn)定鍍液,可以加入緩沖劑、穩(wěn)定劑等等。
3、陽(yáng)極調(diào)整劑
陽(yáng)極的順利和正常溶解,對(duì)于鍍液使用中的平衡和穩(wěn)定至關(guān)重要。陽(yáng)極的溶解速度須與陰極的沉積速度相協(xié)調(diào),否則會(huì)影響沉積離子的物料平衡。陽(yáng)極常會(huì)有鈍化、掛灰、反常損耗等現(xiàn)象,都會(huì)直接影響鍍層的質(zhì)量。例如陽(yáng)極灰的脫落而在溶液內(nèi)懸浮,勢(shì)必污染槽液并會(huì)夾帶到鍍層中。陽(yáng)極溶解的形態(tài)不正常也會(huì)引起雜質(zhì)懸浮和材料的浪費(fèi)。如果采用完全不溶的惰性陽(yáng)極,則鍍液須及時(shí)調(diào)整來(lái)維持離子的正常濃度。
4、鍍液附加劑
通常為了調(diào)整一項(xiàng)或多項(xiàng)指標(biāo),要往鍍液配方中增加一些物質(zhì)。這些物質(zhì)目前一般還需通過(guò)嘗試或根據(jù)經(jīng)驗(yàn)總結(jié)來(lái)確定,包括無(wú)機(jī)物、有機(jī)或天然物質(zhì)以及人工合成的化合物。例如改善鍍液的分散能力、細(xì)化鍍層晶粒、增加平整和光亮度、消除鍍層麻點(diǎn)等。由于幾種物質(zhì)的搭配常有協(xié)同并增強(qiáng)的效果,所以商品的添加劑也常用幾種材料配合應(yīng)用。
目前生產(chǎn)上采用的鍍液仍以水溶液為主。有機(jī)溶劑或其與水的混合物、熔融的鹽類等也已逐漸在生產(chǎn)中獲得應(yīng)用,特別是用于水溶液不能或難于沉積的金屬的沉積。但由于操作控制比起慣用的水溶液相對(duì)較難,所以還不很普遍。對(duì)于從水溶液中無(wú)法析出的金屬,利用非水溶劑或熔鹽是目前惟一可行的方案。非水鍍液具有的一些優(yōu)點(diǎn),也在促使本來(lái)習(xí)慣用水溶液的工藝向非水方向轉(zhuǎn)移。因此,總體來(lái)說(shuō)用于電鍍的鍍液體系實(shí)際包含水與非水體系,也包括部分加水的混合體系。
三、電結(jié)晶過(guò)程
從水溶液中鍍?nèi)″儗邮悄壳半婂兩a(chǎn)工藝的主要方式。電沉積出來(lái)的鍍層大多數(shù)情況下呈晶態(tài),包括柱狀或?qū)訝畹木B(tài)結(jié)構(gòu),同時(shí)也有微晶、納米晶和非晶結(jié)構(gòu),結(jié)構(gòu)的形成取決于沉積過(guò)程的條件。
大多數(shù)情況下,目前通用的鍍層均為晶態(tài)結(jié)構(gòu)。由于沉積過(guò)程表現(xiàn)為形成晶態(tài)的過(guò)程,便將這一過(guò)程看做是電場(chǎng)影響下的結(jié)晶過(guò)程而稱為電結(jié)晶。電結(jié)晶過(guò)程類似于但也有別于從溶液中因過(guò)飽和而形成的普通的結(jié)晶過(guò)程。晶態(tài)的鍍層是由放電后的離子按照一定的晶體結(jié)構(gòu)規(guī)律順序排列而成的一種有序結(jié)構(gòu)。用以形成晶體點(diǎn)陣的是單個(gè)的放電離子,而離子放電之前在溶液中帶有一定的規(guī)整的電荷。電荷在電極界面上通過(guò)電子交換而被外加電流所中和。所以中和所需的電量取決于離子放電時(shí)粒子的數(shù)量和所帶的電荷量,彼此間形成一定的定量關(guān)系。這種以粒子計(jì)數(shù)為基礎(chǔ)的規(guī)律便以法拉第定律來(lái)表述。
電鍍的電源不論是恒穩(wěn)直流或是帶有波紋,鍍槽內(nèi)流過(guò)的電量均表現(xiàn)為電流與時(shí)間乘積之和。在從t1至 t2 的時(shí)間內(nèi),電量

如果電流波形恒穩(wěn),便可直接寫成

當(dāng)流過(guò)的電流同時(shí)也引發(fā)其他副反應(yīng)時(shí),實(shí)際用于沉積鍍層的電量QM與流過(guò)的總電量之比,稱為電流效率。

如果電流完全用于沉積鍍層,& & !;如電流完全耗于副反應(yīng),例如析氫,則 f=0。
在實(shí)際的電鍍過(guò)程中

電流效率 & 一般習(xí)慣用百分?jǐn)?shù)表示。
依照法拉第第一定律,析出物的質(zhì)量

而按第二定律

于是有

或

式中,M為分子量,而 n 為反應(yīng)轉(zhuǎn)移的電荷數(shù)(化合價(jià))。比例常數(shù)F稱為法拉第常數(shù),其值等于每摩爾的粒子數(shù)即Avogadro(阿佛加德羅)數(shù)乘以電子電荷,近似為96500/mol。
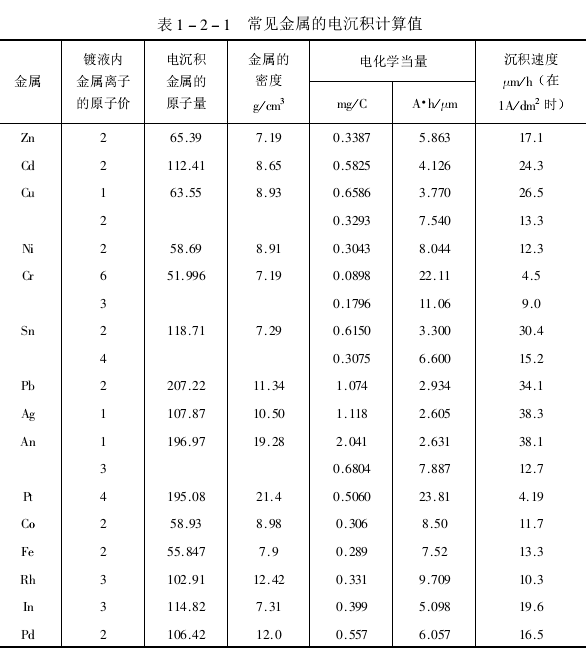
根據(jù)式(2-8),考慮電鍍時(shí)的電流密度、被鍍的表面積和鍍層的密度,便能算出電鍍的速度或沉積一定厚度鍍層所需的時(shí)間。對(duì)于具體的鍍液,還應(yīng)計(jì)入電流效率。法拉第常數(shù)是一個(gè)普適常數(shù)。但實(shí)際工程計(jì)算中看似均勻平整的表面,實(shí)際上并非理想平滑而各處的電流密度也不盡相同。因而理論計(jì)算值與實(shí)測(cè)值常有出入。比較容易的參考值是按表觀值和平均電流來(lái)估算。
各種常遇到的金屬的值列在表 1-2-1 中,可供參考